Aprenda a fazer a distribuição eletrônica dos elétrons na eletrosfera do átomo.
Distribuição em níveis de energia
Nos elementos químicos conhecidos, os átomos podem distribuir-se em 7 níveis de energia (contendo elétrons) que são representados, em sequência, a partir do núcleo, pelas letras K, L, M, N, O, P, Q ou pelos números 1, 2, 3, 4, 5, 6, 7. Estes números são chamados de números quânticos principais, eles representm a aproximada distância do elétron ao núcleo, como também a energia do elétron. Se um elétron tem número quântico principal igual a 3, ele pertence à camada M e tem a energia desse nível.
.jpg)
Camada de valência
O nível de energia mais externo do átomo é denominado camada de valência. Assim, no átomo do exemplo anterior é a camada M. Ela pode conter, no máximo, 8 elétrons.
Regras
1 - Vai distribuindo os elétrons de acordo com a quantidade que cada camada aguenta (K=2; L=8; M=18; N=32; O=32; P=18; Q=8)
2 - Na última camada, chamada camada de valência, não pode ficar mais do que 8 elétrons.
3 - Se na última camada ficar mais do que 8 elétrons para serem distribuídos fazer o seguinte:
3.1 se o numero for entre 8 e 18: coloca oito na penúltima camada e o restante continua distribuindo.
3.2 se o número for entre 18 e 32: coloca dezoito na penúltima camada e o restante continua distribuindo.
Exemplo:
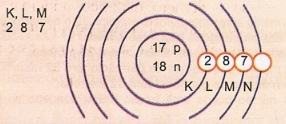
Represente, esquematicamente, o átomo de número atômico 17 (Cloro - Cl)
Nº atômico
|
K
(2)
|
L
(8)
|
M
(18)
|
N
(32)
|
O
(32)
|
P
(18)
|
Q
(8)
|
|
Na (Sódio)
|
11
|
2
|
8
|
1
|
||||
C
(Carbono)
|
6
|
2
|
4
|
|||||
As
(Arsênio)
|
33
|
2
|
8
|
18
|
5
|
|||
Cl (Cloro)
|
17
|
2
|
8
|
7
|
||||
Ouro(Au)
|
79
|
2
|
8
|
18
|
32
|
18
|
1
|
|
Iodo (I)
|
53
|
2
|
8
|
18
|
18
|
7
|
||
Rádio (Ra)
|
88
|
2
|
8
|
18
|
32
|
18
|
8
|
2
|
Chumbo
(Pb)
|
82
|
2
|
8
|
18
|
32
|
18
|
4
|
Explicação das respostas da tabela acima
Em Na, C, As e Cl a distribuição é simples, basta ir distribuindo observando quanto camada suporta. Sempre no final o número de elétrons que sobrou foi menor que oito na última camada.
Em Au (ouro) - Quando chega na camada "O", sobra 19 elétrons, a camada até aguenta, pois a camada "O" suporta 32 elétrons. Porém, não podemos deixar mais do que 8 elétrons na ultima camada. Então, como 19 está entre 18 e 32 (regra 3.2 acima) devemos deixar 18 elétrons na camada "O" e o restante (1) na última camada.
Em I (iodo) sobra 25 na camada N. Então, como 25 está entre 18 e 32 (regra 3.2 acima) devemos deixar 18 elétrons na camada N e o restante (7) na última camada.
Em Ra (rádio) sobra 28 na camada "O". Então, como 28 está entre 18 e 32 (regra 3.2 acima) devemos deixar 18 elétrons na camada "O" e o restante (10) continua sendo distribuído. Como o que restou (10) está entre 8 e 18 (regra 3.1 acima) devemos deixar 8 elétrons na camada "P" e o restante (2) na última camada.
Em Pb (chumbo) sobra 22 na camada "O". Então, como 22 está entre 18 e 32 (regra 3.2 acima) devemos deixar 18 elétrons na camada "O" e o restante (4) na camada P.